خلاصة
يمكن أن يؤثر إدخال AuNRs و PPTT على الاتصال بين الهيكل الخلوي والخلية، مما يُثبط الهجرة الجماعية للخلايا السرطانية. وقد لاحظ STORM أيضًا اختلال الهيكل الخلوي للأكتين باستخدام مجهر فائق الدقة، بينما استُخدم مجهر آخر لتسجيل صور DIC في تجارب تكبير (حتى 200x). أظهرت النتائج أن AuNRs المستهدفة بالإنترجرين والتفاعلات بين الخلايا يمكن أن تُحفز تغيرات الفسفرة. كما أن التغيرات في مورفولوجيا هذه الجزيئات أو مستويات تعبيرها، وهي مكونات أساسية لخيوط الهيكل الخلوي والوصلات الخلوية، تُثبط هجرة الورم.
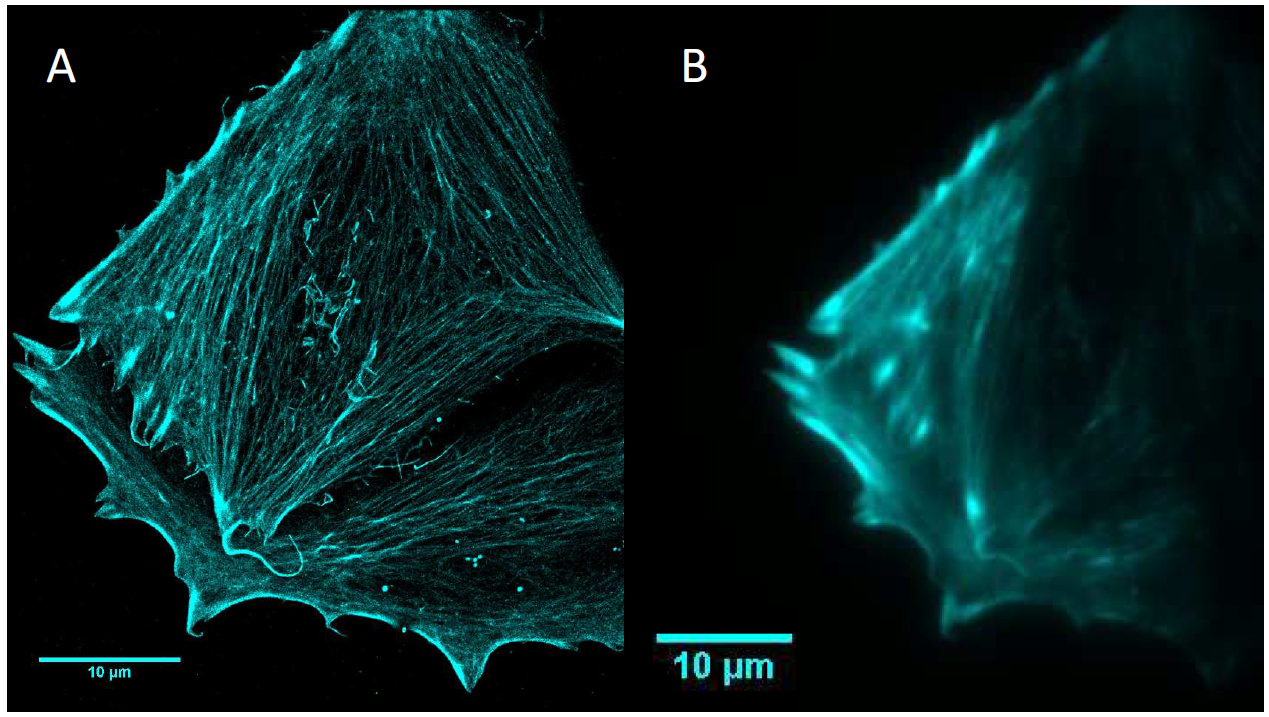
الشكل 1 مقارنة بين دقة التصوير المجهري STORM (أ) والتصوير المجهري الفلوري التقليدي (ب) لخيوط الأكتين.
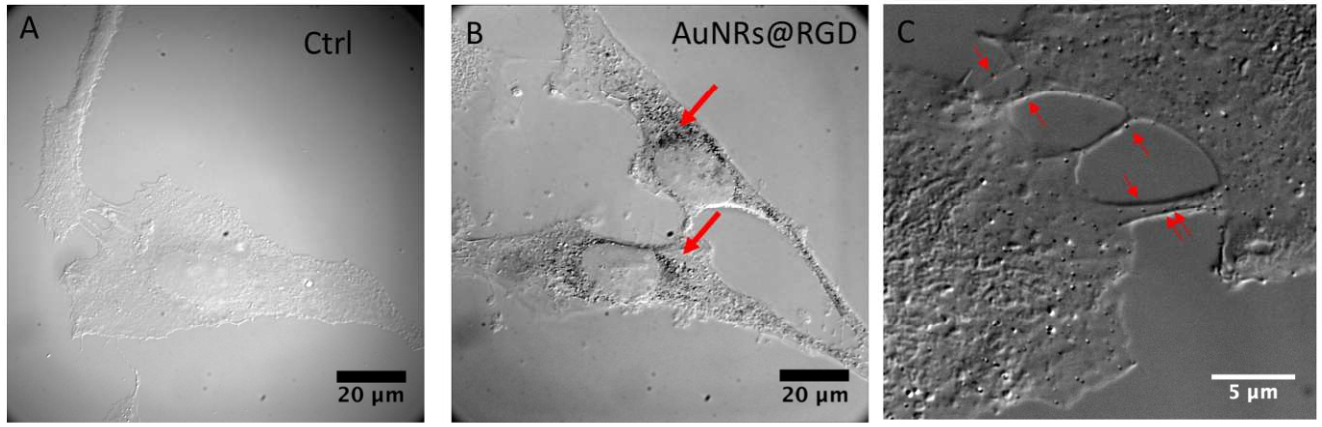
الشكل 2 امتصاص الخلايا والسمية الخلوية والحركة عند علاجات AuNRs. (AB) التفاضلية
صور مجهرية للتداخل والتباين (DIC) لخلايا هيلا بدون (أ) ومع
AuNRs@RGD بعد 24 ساعة من الحضانة (ب). (ج) صورة DIC لـ AuNRs@RGD موزعة في مناطق تقاطع الخلايا بعد 24 ساعة من الحضانة.
تحليل تكنولوجيا التصوير
من الصعب على المجهر الفلوري التقليدي اختراق حدود الحيود الضوئي، فهو غير قادر على ملاحظة تأثير إدخال قضبان الذهب النانوية و PPTT على الخلايا، وبدون دقة فائقة، من المستحيل تصويرها.دايانا 95و400BSIكاميرات sCMOS مدمجة، قوية ومرنة، ومثالية لهذا التطبيق. تتميز الكاميرتان بمجموعة متنوعة من الأوضاع، بما في ذلك وضع قراءة CMS منخفض الضوضاء ووضع الديناميكية العالية. لا تحقق كاميرات Backshot sCMOS كفاءة كمية شبه مثالية بنسبة 95% فحسب، بل تتميز أيضًا بمجال رؤية واسع يصل إلى 2 بوصة. الاستجابة الطيفية الواسعة التي تتراوح بين 200 و1100 نانومتر تُحسّن حساسية ونطاق ديناميكيات وحدات البكسل الكبيرة (11 ميكرومتر)، وهو ما لا تتمتع به كاميرات sCMOS الأخرى. لذلك، يمكن إجراء التصوير بكثافة إضاءة أقل ووقت تعريض أقصر على مدى فترة زمنية أطول دون التسبب في تلف ضوئي أو تبييض ضوئي للعينات.
المصدر المرجعي
وو ي، علي إم آر كي، دونغ ب، هان ت، تشن ك، تشن ج، تانغ ي، فانغ ن، وانغ ف، السيد م أ. العلاج الضوئي الحراري باستخدام قضبان الذهب النانوية يُغيّر الوصلات الخلوية وشبكة الأكتين في تثبيط الهجرة الجماعية لخلايا السرطان. ACS Nano. 25 سبتمبر 2018؛ 12(9):9279-9290. doi: 10.1021/acsnano.8b04128. نُشر إلكترونيًا في 27 أغسطس 2018. PMID: 30118603؛ PMCID: PMC6156989


 2022/03/03
2022/03/03