추상적인
AuNR과 PPTT의 도입은 세포골격과 세포 간의 연결에 영향을 미쳐 암세포의 집단 이동을 억제할 수 있습니다. 액틴 세포골격의 파괴는 초고해상도 현미경을 이용한 STORM으로 추가로 관찰되었으며, 또 다른 현미경을 사용하여 배율 실험(최대 200배)에서 DIC 이미지를 기록했습니다. 결과는 인테그린을 표적으로 하는 AuNR과 세포 간 상호작용이 인산화 변화를 유발할 수 있음을 보여주었습니다. 세포골격 필라멘트와 세포 연결의 핵심 구성 요소인 AuNR의 형태 또는 발현 수준의 변화 또한 종양 이동을 억제합니다.
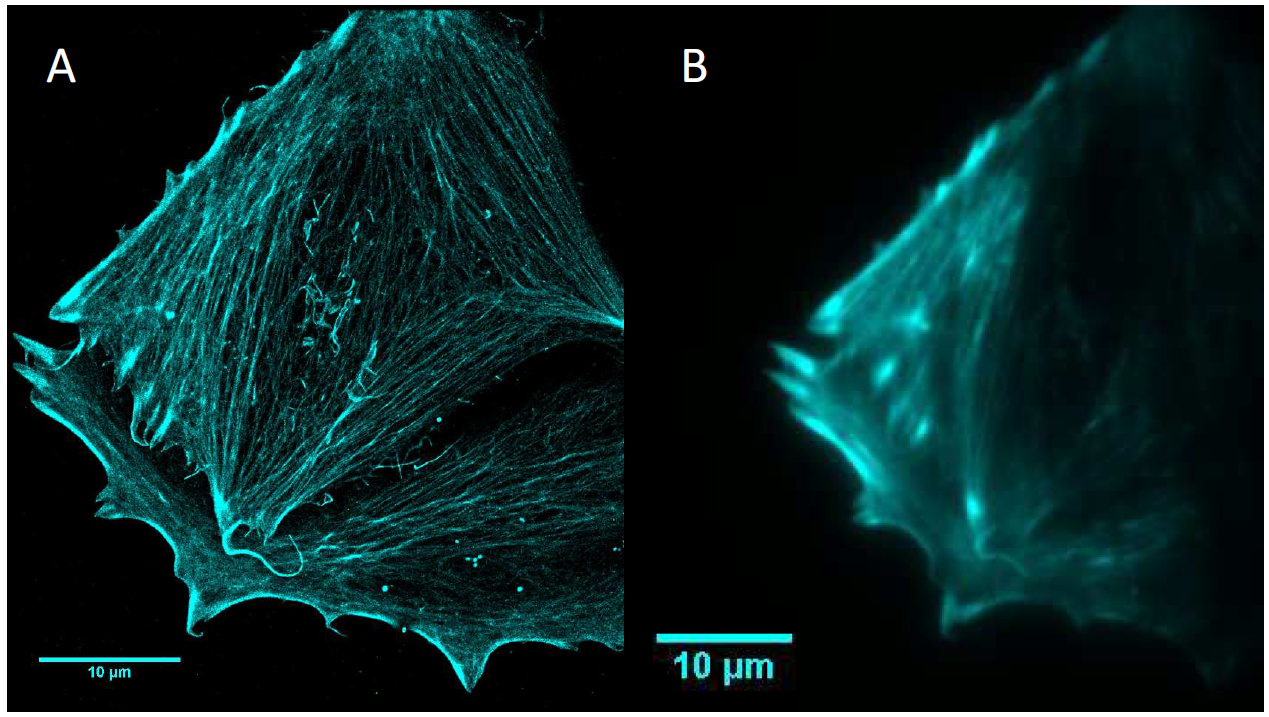
그림 1 액틴 필라멘트에 대한 STORM(A)과 기존 형광 현미경 이미징(B)의 해상도 비교.
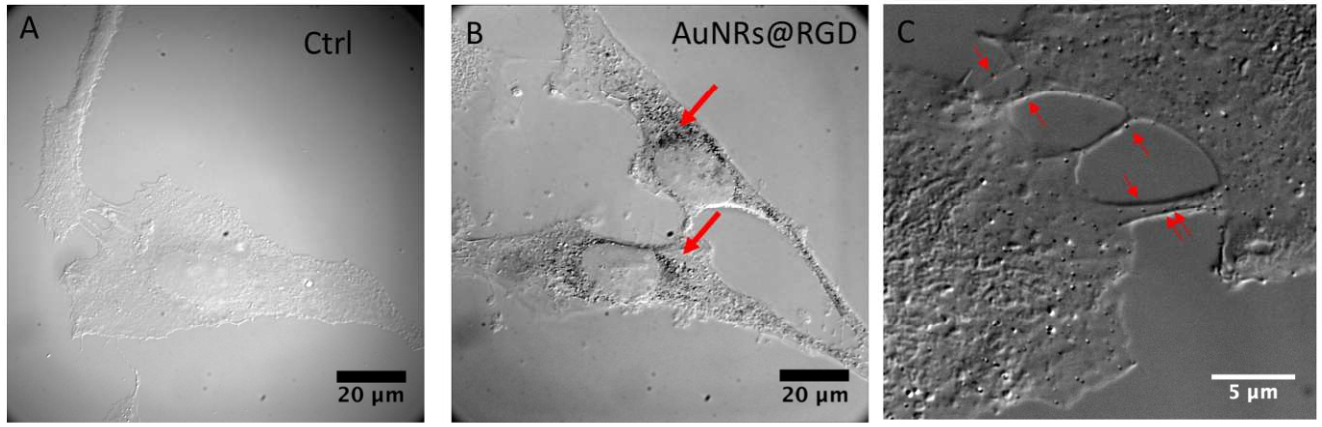
그림 2 AuNRs 처리에 따른 세포 흡수, 세포 독성 및 이동성. (AB) 차등
HeLa 세포의 간섭 대비(DIC) 현미경 이미지(A)와 간섭 대비(DIC)가 없는 이미지(A)와 간섭 대비(DIC)가 있는 이미지
24시간 배양 후 AuNRs@RGD(B). (C) 24시간 배양 후 AuNRs@RGD가 세포 접합 부위에 분포하는 DIC 이미지.
영상기술 분석
전통적인 형광현미경은 광학 회절의 한계를 돌파하기 어렵고, 금 나노로드와 PPTT가 세포에 미치는 영향을 관찰할 수 없으며, 초고해상도 없이는 이를 영상화하는 것이 불가능합니다.디아나 95그리고400BSI카메라는 이러한 응용 분야에 이상적인 두 대의 작고 강력하며 유연한 sCMOS 카메라입니다. 이 카메라는 CMS 저잡음 판독 모드와 고동적 모드를 포함한 다양한 모드를 제공합니다. 백샷 sCMOS는 거의 완벽한 95% 양자 효율을 달성할 뿐만 아니라 2인치와 같은 넓은 시야각을 제공합니다. 200~1100nm의 넓은 스펙트럼 응답은 다른 sCMOS 카메라에는 없는 11um 픽셀의 감도와 동적 범위를 향상시키는 데 도움이 됩니다. 따라서 샘플의 광 손상 및 광퇴색 없이 더 낮은 조도와 더 짧은 노출 시간으로 더 오랜 시간 동안 이미징을 수행할 수 있습니다.
참고 출처
Wu Y, Ali MRK, Dong B, Han T, Chen K, Chen J, Tang Y, Fang N, Wang F, El-Sayed MA. 금 나노로드 광열 치료는 암세포 집단 이동을 억제하는 데 있어 세포 접합부와 액틴 네트워크를 변화시킨다. ACS Nano. 2018년 9월 25일;12(9):9279-9290. doi: 10.1021/acsnano.8b04128. Epub 2018년 8월 27일. PMID: 30118603; PMCID: PMC6156989


 2022년 3월 3일
2022년 3월 3일