תַקצִיר
הכנסת AuNRs ו-PPTT יכולה להשפיע על הקשר בין שלד התא לתא, ובכך לעכב את הנדידה הקולקטיבית של תאי סרטן. שיבוש שלד התא של אקטין נצפתה עוד על ידי STORM באמצעות מיקרוסקופ בעל רזולוציה גבוהה, בעוד שמיקרוסקופ נוסף שימש לרישום תמונות DIC בניסויי הגדלה (עד פי 200). התוצאות הראו כי AuNRs המכוונים לאינטגרין ואינטראקציות בין תאים עלולות לעורר שינויים בזרחון. שינויים במורפולוגיה שלהם או ברמות הביטוי שלהם, שהם מרכיבים מרכזיים של סיבים שלדיים וקשרים בין תאים, מעכבים גם הם נדידת גידולים.
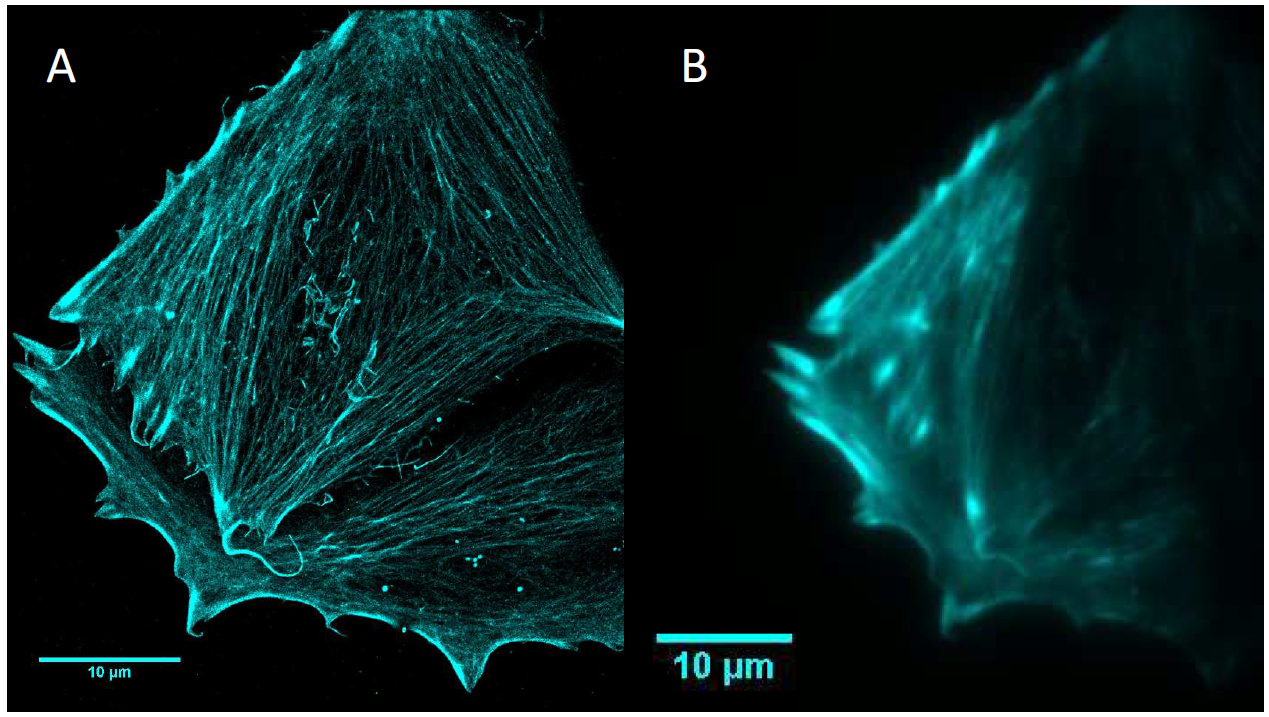
איור 1. השוואה בין הרזולוציה של מיקרוסקופ פלואורסצנטי STORM (A) לבין מיקרוסקופ פלואורסצנטי קונבנציונלי (B) עבור סיבי אקטין.
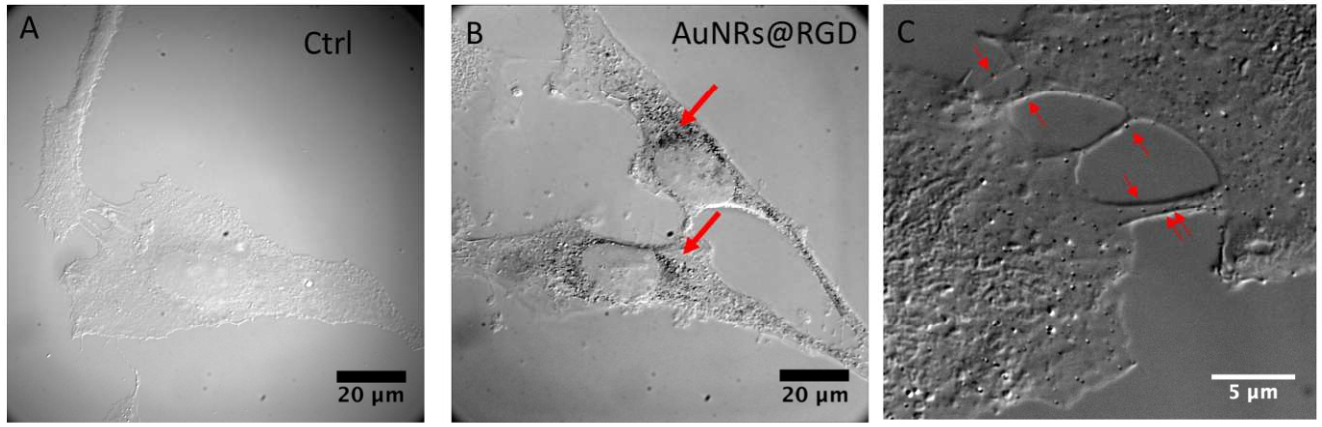
איור 2. קליטה תאית, ציטוטוקסיות ותנועתיות לאחר טיפולי AuNRs. (AB) דיפרנציאל
תמונות מיקרוסקופיות של תאי HeLa באמצעות ניגודיות התאבכות (DIC) ללא (A) ועם (A)
AuNRs@RGD לאחר דגירה של 24 שעות (B). (C) תמונת DIC של AuNRs@RGD מתפזר באזורי צומת התאים לאחר דגירה של 24 שעות.
ניתוח טכנולוגיית הדמיה
מיקרוסקופ פלואורסצנטי מסורתי קשה לפרוץ את גבול הדיפרקציה האופטית, אינו מסוגל לצפות בהשפעת החדרת ננו-מוטות זהב ו-PPTT על תאים, ללא רזולוציה-על, בלתי אפשרי לצלם אותם.דיאנה 95ו400BSIמצלמות sCMOS קומפקטיות, חזקות וגמישות, אידיאליות ליישום זה. למצלמות מגוון מצבים שונים, כולל מצב קריאת רעש נמוך של CMS ומצב דינמי גבוה. sCMOS Backshot לא רק משיג יעילות קוונטית כמעט מושלמת של 95%, אלא גם בעל שדה ראייה גדול כמו 2 אינץ'. התגובה הספקטרלית הרחבה של 200-1100 ננומטר תורמת לשיפור הרגישות והטווח הדינמי של פיקסלים בגודל 11 מיקרון, יתרונות שאין למצלמות sCMOS אחרות. לכן, ניתן לבצע הדמיה בעוצמת תאורה נמוכה יותר ובזמן חשיפה קצר יותר לאורך זמן ארוך יותר מבלי לגרום לנזק אור ולהלבנת דגימות.
מקור ההפניה
וו י', עלי מרק, דונג ב', האן ט', צ'ן ק', צ'ן ג'יי', טאנג י', פאנג נ', וואנג פ', אל-סייד מ"א. טיפול פוטותרמי בננו-מוט זהב משנה צמתים תאיים ורשת אקטין בעיכוב נדידת תאים סרטניים קולקטיבית. ACS Nano. 25 בספטמבר 2018;12(9):9279-9290. doi: 10.1021/acsnano.8b04128. Epub 27 באוגוסט 2018. PMID: 30118603; PMCID: PMC6156989

 22/03/03
22/03/03